Los trabajos de esta disciplina se orientan a la industria farmacéutica, informática y de la salud, sostuvo Carlos Schvezov en la apertura de la Vª reunión nacional del tema POSADAS. “Gracias a los estudios de los cristales, que iniciaron hace más de dos décadas, hoy en día hay avances importantes en la industria farmacológica -con el estudio de las estructura cristalinas de las moléculas que componen el organismo humano y las moléculas de distintos medicamentos-, en la informática -con el desarrollo, aplicación y perfección de los cristales semiconductores, entre otras”, sostuvo el doctor Carlos Schvezov quien conforma la Asociación Argentina de Cristalografía y es el titular del Cedit al actuar como anfitrión ayer del evento.
Fue en el marco del acto de apertura la Vª Reunión de la Asociación de Cristalografía donde científicos de todo el país debatirán sobre estudios de esta ciencia y sus distintas aplicaciones.
“La cristalografía es una ciencia tan amplia que aborda diversas disciplinas: física, química, materiales -que en realidad, materiales es la básica porque el cristal es un material- la biología molecular, la biología en sí, la farmacología, prácticamente todas. Y como es transversal a todas las otras disciplinas científicas, lo que hacemos es juntarnos para debatir sobre en el tema de cristales desde las distintas disciplinas y aplicaciones para hacer un trabajo interdisciplinario”, indicó Schvezov.
En qué consiste
La cristalografía es una ciencia que estudia las estructuras de los cristales, que son materiales que se pueden encontrar en la naturaleza y que se pueden producir a partir de cualquier elemento, como el cabello. “La cristalografía puede parecer una ciencia extraña a mucha gente que no está familiarizada, pero se trata del estudio de la estructura de los cristales. Un cristal es un sólido con una estructura determinada de moléculas constituyentes. Para dar un ejemplo de un cristal muy
simple tenemos la sal, que es un elemento que está en nuestra vida diaria”, explicó el especialista.
Distintas aplicaciones
Así, los estudios desarrollados por esta ciencia son de importancia fundamental para los avances
en materia de biología molecular, industrias farmacéuticas e industrias informáticas.
“La cristalografía es de importancia fundamental en los estudios en biología molecular. Ya que permite estudiar una bio-molécula - que es una molécula que tenemos en nuestro cuerpo- y saber que importancia tienen en distintas partes de nuestro metabolismo, ya sea para cura o entender como funcionan”, señaló Schvezov.
Además, hay otro trabajo muy importante a nivel local que se está llevando a cabo que tiene que ver con la producción de la primera válvula cardíaca (Ver “También en la válvula cardíaca”) Gracias a la cristalografía, se puede hacer cristales a partir de moléculas que componen el cuerpo humano, lo que posibilita el entendimiento de la interacción entre las moléculas humanas y las moléculas que componen determinado medicamento (ver Aplicaciones en la farmacología).
Otra de las aplicaciones que tiene está ciencia tiene que ver con el auge y avance de las industrias informáticas, cristales semiconductores y pantallas de cristal líquidos son inventos tecnológicos hechos realidad por los estudios de la cristalografía (ver Tecnología LCD).
Aplicaciones en la farmacología
Hacer cristales de moléculas que conforman el cuerpo humano permite estudiar la composición y
comportamiento del mismo.
“A través de estudios sobre cómo se comporta, podemos descubrir por donde atacarla mejor si es algo dañino. Entonces, ahí aparece la industria farmacológica”, indicó el doctor Carlos Schvezov. Es el entendimiento de cómo es la interacción de moléculas nuestras con las moléculas de los medicamentos. Un ejemplo claro tiene que ver la aparición de piedras en riñón o vesícula, un problema muy frecuente en el ser humano. “Cuando uno tiene cálculos en el riñón o vesícula es importante determinar no sólo el tipo de cristales que se están formando -calcios y otros- para poder eliminarlos sino también para encontrar un mecanismo de prevención para que no se formen más”, señaló Schvezov.
Tecnología LCD
“La industria informática logra cristales semiconductores que perfeccionan dispositivos cada vez más pequeños”, señaló Carlos Schvezov. “En el caso de pantallas de cristal líquido (LCD),estos cristales tienen un ordenamiento específico y fue la cristalografía la ciencia que permitió el desarrollo de todo este tipo de display”.
También en la válvula cardíaca
En el recubrimiento de las válvulas cardíacas locales también va la cristalografía. “El equipo de trabajo se orienta al comportamiento de ciertas partículas cuando solidifican los cristales y también en la composición cristalina que aparecen el recubrimiento de las válvulas mecánicas cardíacas”, indicó el doctor Schvezov. Son las válvulas desarrolladas localmente y construidas con titanio y probadas en junio en el Sincrotrón de Brasil. “Las estamos construyendo con titanio y que se depositan cristales que forman películas muy pequeñas y delgadas cuya caracterización es muy difícil”.



















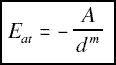 donde A es una constante que depende del tipo de átomos y m una que depende del tipo de enlace. Por tanto, la fuerza con que se atraen es la derivada de esta expresión:
donde A es una constante que depende del tipo de átomos y m una que depende del tipo de enlace. Por tanto, la fuerza con que se atraen es la derivada de esta expresión:
 Pero si solo existiese esta fuerza, que es más grande para distancias pequeñas, el sistema llegaría a colapsar porqué los dos átomos acabarían interpenetrados, y la experiencia demuestra que no es así, que los átomos tienen cierto tamaño y que los sistemas no colapsan. Debe existir, por tanto, una energía de repulsión que, a cierta distancia, contrarreste la de atracción. Por tanto, la energía del sistema debe ser
Pero si solo existiese esta fuerza, que es más grande para distancias pequeñas, el sistema llegaría a colapsar porqué los dos átomos acabarían interpenetrados, y la experiencia demuestra que no es así, que los átomos tienen cierto tamaño y que los sistemas no colapsan. Debe existir, por tanto, una energía de repulsión que, a cierta distancia, contrarreste la de atracción. Por tanto, la energía del sistema debe ser
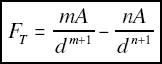 respecto de las constantes m y n, dependiendo de la clase de atracción y repulsión que tenga lugar, se pueden considerar tres posibilidades m>n, m=n, y m
respecto de las constantes m y n, dependiendo de la clase de atracción y repulsión que tenga lugar, se pueden considerar tres posibilidades m>n, m=n, y m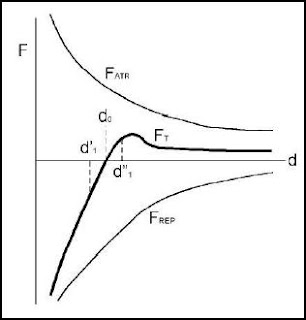
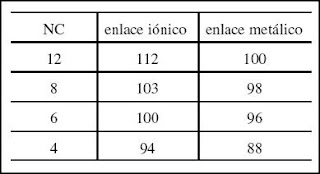
 Pero en una estructura cristalina los átomos no están libres, sino enlazados con otros, y además, hay cierta interpenetración de las capas electrónicas más externas, que participan del enlace. Por tanto, en una estructura cristalina se puede definir la distancia de enlace como aquella que separa los dos centros de dos átomos próximos.
Pero en una estructura cristalina los átomos no están libres, sino enlazados con otros, y además, hay cierta interpenetración de las capas electrónicas más externas, que participan del enlace. Por tanto, en una estructura cristalina se puede definir la distancia de enlace como aquella que separa los dos centros de dos átomos próximos.