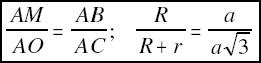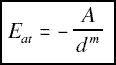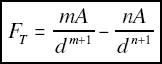Esta es la parte de la Cristalografía que estudia las estructuras cristalinas, es decir la disposición de los átomos y moléculas que forman el edificio cristalino, las causas de su ordenación, las propiedades que esta implica, etc.
De hecho, las propiedades de cualquier compuesto están controladas, no únicamente por su composición química, sino también por como sus átomos están distribuidos y enlazados en la estructura cristalina. Un caso paradigmático es el carbono, que en sus formas diamante y grafito da lugar a dos minerales de propiedades bien diferentes (entre ellas el precio).
En estos apuntes sobre Cristaloquímica se supone que el lector está familiarizado con la
estructura electrónica de los átomos, sus propiedades más significativas (potenciales de
ionización, electronegatividad...), así como con los tipos de enlace químico más comunes.
ENLACES QUIMICOS EN LOS CRISTALES
La manera como se ordenan los átomos en una estructura cristalina depende de las medidas de estos átomos y de las fuerzas de unión (de enlace) que mantienen las partículas estructurales juntas. Para una presión y temperatura determinadas, el conjunto de átomos de un cristal en equilibrio adopta una estructura que minimiza la entalpia libre G.
G = U + PV - TS
donde G es la entalpia de Gibbs, U la energía interna, P la presión, T la temperatura absoluta, V el volumen y S la entropía.
De acuerdo con esta expresión, a 0ºK la estructura más estable es la más compacta (que minimiza V) y la que tenga menor energía interna (U tiene signo negativo).
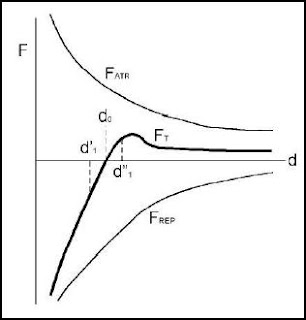
Por lo que hace referencia a la energía interna de un cristal (en valor absoluto) es la suma de las energías de enlace, las cuales a la vez, dependen de las fuerzas de atracción y repulsión de los átomos. La naturaleza de estas fuerzas determina el comportamiento físico-químico del cristal, y de hecho por eso, más adelante, se clasificarán de acuerdo con el tipo de enlace químico predominante.
En física se conocen tres tipos de fuerzas:
a) fuerzas gravitacionales, débiles y que operan a grandes distancias (astronómicas), vinculadas a la masa. Son las que mantienen en equilibrio el sistema planetario.
b) fuerzas eléctricas y magnéticas, mayores que las anteriores, ligadas a las cargas eléctricas y a sus desplazamientos, operan a distancias mucho menores que las gravitacionales.
c) fuerzas nucleares, aún más grandes, pero que operan a distancias muy pequeñas, prácticamente en el interior de los núcleos atómicos.
En una estructura cristalina, las fuerzas gravitacionales son despreciables, y si se considera el núcleo atómico una unidad indivisible, es posible considerar que en el interior del cristal operan las fuerzas eléctricas y magnéticas. No obstante, estas no se pueden estudiar con las leyes de la electrostática clásica (la ley de Coulomb, por ejemplo) porqué las cargas eléctricas (los electrones) están en movimiento y son demasiado pequeñas para que la mecánica newtoniana dé respuesta.. Su estudio requiere una aproximación a través de la mecánica cuántica.
No obstante se puede hacer una aproximación simple que permita explicar algunas de las estructuras cristalinas si se considera el núcleo atómico y las capas electrónicas saturadas como formando parte de un “interior” del átomo que no se modifica al formar parte de una estructura, y que los otros electrones (los de valencia) son los únicos que se reparten entre otros átomos para formar una molécula o una estructura cristalina.
Considerado de esta manera un cristal, la energía de este sistema se puede explicar con la electrostática clásica si se conocen las posiciones de los átomos y la repartición de la densidad electrónica entre estos.
LA FORMA DE LOS ÁTOMOS Y DE LOS IONES
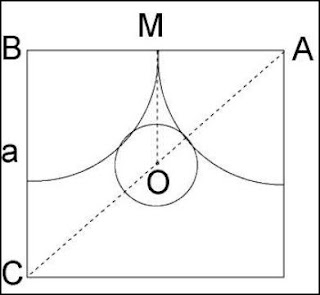
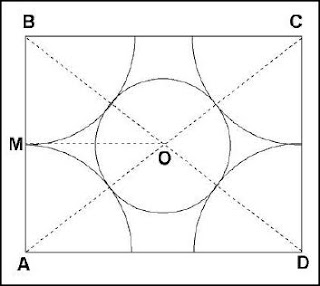
Una aproximación, suficiente para un primer nivel, a las estructuras de los cristales, es
considerarlas como un empaquetado de esferas de diferentes tamaños que representan los átomos y los iones que las forman. Esto equivale a imaginar los átomos de forma esférica, la cual cosa no se corresponde con las distribuciones de probabilidad radial de los orbitales que los forman: excepto los s, el resto tienen una forma más o menos lobular. En general se puede afirmar que la forma de un átomo será la suma de sus orbitales más exteriores ocupados
La forma de los metales alcalinos y alcalinotérreos (Li, Na, K, Rb, Fr, y Ca, Mg, etc.) Es esférica porqué lo es su orbital más externo (los 1s, 2s, 3s, 4s y 5s, respectivamente). Pero eso es diferente para los átomos que tienen ocupados orbitales p, como por ejemplo el boro (Z=5, configuración electrónica 1s2, 2s2, 2p1), que tendrá una forma claramente alargada. La situación es ligeramente diferente para el C (Z=6, que tiene semillenos los orbitales 2px y 2py) que tendría una forma de esfera aplanada, o para el N (Z=7) que con sus tres orbitales 2p semillenos, se parece más a la simetría esférica.
No obstante, en una estructura cristalina los átomos no están libres, sino enlazados con otros átomos. La tendencia de los átomos cuando se enlazan es acerca su configuración electrónica a la de un gas noble, la cual cosa suele estar más cercana a la forma esférica que el átomo libre. Los iones C+4 o el B+3 han perdido los electrones de los orbitales 2p y 2s, y su simetría esférica corresponde a la del nivel 1s.
El átomo libre de oxígeno (Z=8) tiene una configuración electrónica 1s2, 2s2, 2p4, mientras que el ión O-2 gana dos electrones respecto del átomo de oxígeno libre y como que tres orbitales 2p quedan saturados, adquiere una simetría más esférica. Igualmente pasa con el silicio (Z=14), las configuraciones electrónicas de su átomo libre y de su catión Si+4 son:
Si 1s2, 2s2, 2p6, 3s2, 3p2
Si+4 1s2, 2s2, 2p6
Es decir, que la aproximación a esferas de los átomos de las estructuras cristalinas, como un primer paso para su comprensión, no es descabellada, y se puede adoptar como modelo simple.